إنها إحدى أساسيات الكيمياء: الكربون لا يمكن أن يشكل سوى أربع روابط كيميائية لأنَّهُ ليس لديه سوى أربعة إلكترونات مشاركة.
ولكن هذه القاعدة أمست وراء الشمس، لأن العلماء قد أكدوا وجود جزيء كربون غريب يمكنه أن يُشكل ستة روابط كيميائية، وهذا يعني أن المثال الأكثر كلاسيكية من tetravalence (في الكيمياء، هي حالة ذرة لها أربع إلكترونات متاحة لتشكيل روابط كيميائية تساهمية في التكافؤ) في كتب الكيمياء للمدرسة الثانوية يستدعي الآن مزيداً من الحذر.
إذا كان كل هذا يسبب لك الدوار، فتابع قراءة المقال.
في حين أن عبارة “مزق الكتب المدرسية” صارت تقال طوال الوقت، إلا أن هذا الموقف تحديدًا تنطبق عليه تلك العبارة، لأنَّ الواقع العلمي أكثر تعقيداً ممَّا درسناه في كتب الكيمياء في المدرسة.
وأضاف الكيميائي (Dean Tantillo) بجامعة كاليفورنيا، ديفيس، والذي لم يكن جزءًا من الدراسة: «من المهم أن يدرك الناس أنه على الرغم من أننا دُرسنا أنَّه لا يمكن للكربون أن يحظى بأكثر من أربعة أصدقاء، إلَّا أنَّهُ يستطيع الارتباط بأكثر من أربع ذرات» مصرحًا لمجلة Science News.
حسناً، هذا ما حدث.
في عام 1973، اقترح باحثون ألمان أنه من الممكن من الناحية النظرية خلق جزيء كربون بستة روابط كيميائية ، وذلك باستخدام سداسي ميثيل البنزن Hexamethylbenzen.
المعروف أيضا باسم الملتين Mellitene، هذا الهيدروكربون يتشكل عند تكَوُن روابط كيميائية بين الكربون والهيدروجين، هكذا:
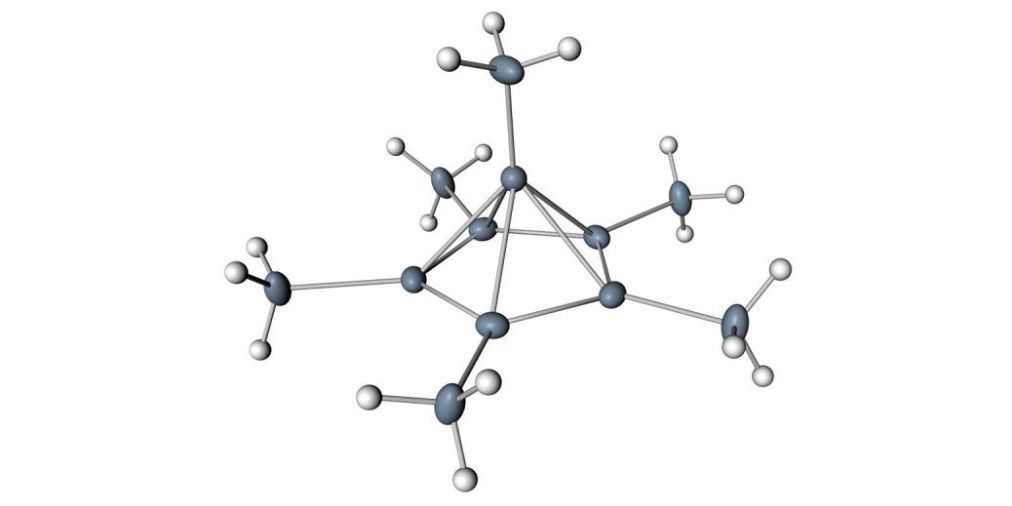
وتتكون هذه الحلقة السداسية المسطحة من ست ذرات كربون رمادية. ترتبط إلى ستة ”أذرع” كربون إضافية وذرات هيدروجين بيضاء.
كما ترون، فإن ذرات الكربون إما أن تشكِّل رابطة مع ثلاث ذرات أخرى من الكربون، أو أن تشكل رابطة مع كربون واحد، وثلاث ذرات الهيدروجين.
في الروابط الكيميائية النموذجية، يتم تقاسم إلكترونين -واحد من كل من الذرة- أَما الإلكترونات المتبقية التي لم تشترك في هذا المُركب تبقى في منتصف حلقة السداسي لتعزيز أواصر القائمة، كما هو مبين من قبل الخطوط المنقطة أعلاه.
ولكن الباحثين الألمان طرحوا السؤال: ماذا يحدث إذا فقد جزيء hexamethylbenzene الالكترونين بدل اكتسابهما؟
واقترحوا أنَّ هذا من شأنه إجبار الجزيء على التحوّل إلى شكل أقل استقرارًا، موجب الشحنة، والذي يتحوَّل بدوره إلى شكل هرم، كما ترون في الصورة أدناه:
“في هذا الترتيب، هناك ستة إلكترونات متاحة لربط الجزء العلوي من الهرم مع كربون خامس في بقية الحلقة والذراع الإضافية، لكن لم يفحص أحد شكل جزيء مرة أخرى، حتى الآن.”
وقرر فريق بقيادة الكيميائي (Moritz Malischewski) من جامعة برلين الحرة بألمانيا، محاولة لتخليق جزيء (hexamethylbenzene) لتأكيد هيكله.
والسبب في أن هذه التجربة أخذت وقتا طويلًا لشخص ما هو أنَّ المُركب مستقر فقط عندما يتكوَّن في حمض قوي للغاية، لذلك عليك حقًا أن تكون ذا خبرة عند استخدام (hexamethylbenzene).
وعندما تبلور المُركب، عرضه الفريق على الأشعة السينية لخلق نموذج ثلاثي الأبعاد من هيكله.
من المؤكد أنهم وجدوا أن اثنين من الالكترونات دُفِعَت خارج الهيكل، والتي غيرت الأمور بشكل كبير في الداخل.
“قفزت إحدى ذرات الكربون للخروج من حلقة، واتخذت موقفًا جديدًا على القمة، مُحولةً بذلك الحلقة السداسية المسطحة إلى هرم خماسي الأوجه”، حسب تقارير (Laurel Hamers) لمجلة ( Science News).
“وكان الكربون الذي على قمة الهرم في الواقع مرتبطاً بستة كربونات أخرى – خمسة في الحلقة السفلية، وواحد فوق.”
ما يجب فهمهُ هنا، أن الروابط المتشكِّلة ليست متساوية، لأنه عِندما يعمل جزيء الكربون ستة روابط، لا يمكن أن تكون قويَّة أو مستقرَّة كما في الروابط الرباعية التي تشكل الغالبية العظمى للمركبات.
“الكربون لا يُكوِّن ستة روابط كما نفكر في رابطة كربون-كربون بل كرابطة إلكترونين”، حسب قول (Tantillo Hamers)، لأن عددًا أقل من الالكترونات يجب أن يشترك في الروابط الستة.
تأكيد هذه الفرضية التي تبلغ من العمر 40 عاما يعني أننا نعلم الآن يقينًا أن الترابط في الكربون هو أكثر تعقيدا بكثير مما كنا نعتقد، وهناك إمكانية لوجود هياكل جزيئية أغرب.
وكما قال (Malischewski) لمجلة (New Scientist)، «لا يمكنكَ أن تحصل كلَّ يوم على صدمة كهذه، حتى الكيميائيين الأكثر رسوخًا في هذا المجال: ” التحدي هو كل شيء، وإمكانية إدهاش الكيميائيين حول ما يمكن أن يكون ممكنًا.”
وقد نشرت الدراسة في جريدة (Angewandte Chemie).
- المترجم: أمين المهدي الصفحي.
- تدقيق: هبة أبو ندى.
- تحرير: كنان مرعي.
- المصدر